BIOCHEMIA: Jak uzyskać surowicę i osocze z krwi?
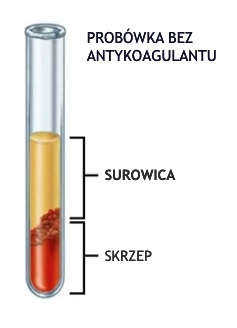
Surowica to płynna frakcja krwi pełnej, którą uzyskuje się po skrzepnięciu krwi. Powstały skrzep usuwa się przez odwirowanie, a powstały supernatant, czyli surowicę ostrożnie usuwa się za pomocą pipety.
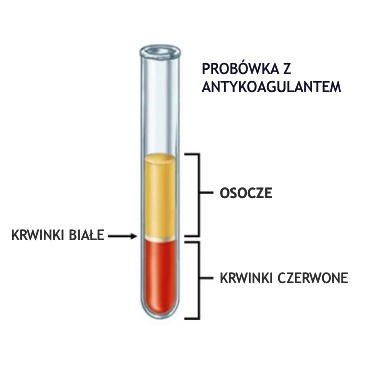
Osocze powstaje, gdy krew pobierana jest do probówek z antykoagulantem. Krew wówczas nie ulega krzepnięciu. Elementy komórkowe krwi (krwinki czerwone, krwinki białe, płytki krwi) usuwa się przez wirowanie. Supernatant, czyli osocze, ostrożnie usuwa się znad osadu komórkowego za pomocą pipety.
UZYSKANIE SUROWICY
Do próbówki z czerwonym korkiem zawierającej aktywator Z należy pobrać krew pełną. Po pobraniu krwi, probówki należy zostawić w temperaturze pokojowej na około 15-30 minut. W tym czasie należy unikać manipulacji z probówkami. Następnie skrzepłą krew należy odwirować przez 10 minut przy obrotach 2000-3000/min. Uzyskaną surowicę należy przenieść do nowych probówek lub niezwłocznie poddać analizie. Surowicę która nie może być zbadana od razu należy zamrozić do czasu dalszych analiz. Surowica lipemiczna, hemolityczna lub ikteryczna (żółtaczkowa) wpływa na wiarygodność wybranych oznaczeń biochemicznych. Ilość uzyskanej surowicy będzie zależna od ilości pobranej krwi, a także od stanu nawodnienia pacjenta.
UWAGA! Krew na badania biochemiczne należy pobierać po 8-12 godzinnej głodówce. W przypadku diagnostyki chorób trzustki obowiązkowa jest 12-godzinna głodówka.
UZYSKANIE OSOCZA
Krew pobiera się do próbówki z lawendowym korkiem która zawiera antykoagulant (EDTA) lub z niebieskim korkiem której wnętrze pokryte jest cytrynianem sodu. Pobraną krew należy ostrożnie wymieszać z antykoagulantem znajdującym się w probówkach, co zapobiegnie powstawaniu skrzepów. Aby uzyskać osocze krew należy odwirować przez 10 minut przy obrotach 1000-2000/min. Uzyskane osocze należy przenieść do nowych probówek i przechowywać w temperaturze chłodniczej lub niezwłocznie poddać analizie. Osocze można także zamrozić do czasu dalszych analiz.
HEMATOLOGIA: Jak prawidłowo pobrać krew do badań morfologicznych?
Aby badanie morfologiczne krwi było jak najbardziej miarodajne należy przestrzegać kilku zasad:
- krew należy pobierać do probówki z antykoagulantem np. EDTA-K2 (probówki z fioletowym/lawendowym korkiem)
- jeśli to możliwe, pierwsza porcja krwi (ok. 0,5ml) powinna zostać odrzucona ze względu na wysokie stężenie czynników krzepnięcia
- podczas pobierania krew powinna swobodnie spływać po ściance probówki
- probówki do hematologii posiadają znacznik poziomu który wskazuje ile krwi do badania należy pobrać
- po pobraniu krwi i zakorkowaniu próbówki jej zawartość należy delikatnie wymieszać
- krew pobrana na EDTA-K2 powinna zostać zbadana jak najszybciej (do 5h jeśli jest przechowywana w temperaturze pokojowej; do 8h jeśli jest przechowywana w temperaturze lodówkowej) – zbyt długie przechowywanie krwi doprowadza do odkształcania erytrocytów i zmian w morfologii płytek krwi
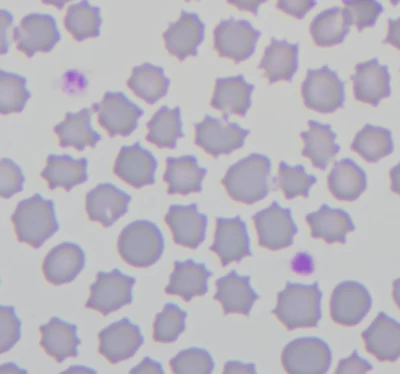
Rozmaz krwi kota – liczne echinocyty i pojedyncze erytrocyty o prawidłowej morfologii. Rozmaz wykonany po 12 godzinach od pobrania krwi.
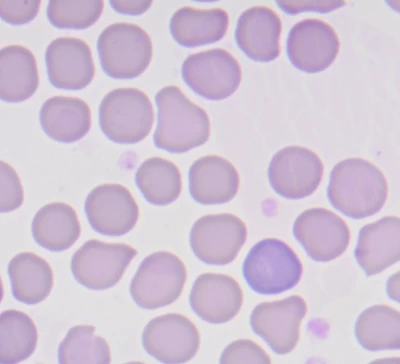
Rozmaz krwi psa – prawidłowe erytrocyty oraz jeden polichromatofilny erytrocyt. Rozmaz wykonany w ciągu 2 godzin od pobrania krwi.

PARAZYTOLOGIA: Jak prawidłowo pobrać kał do badań w kierunku pasożytów jelitowych?
- Kał do badania parazytologicznego należy pobrać przed rozpoczęciem leczenia przeciwpasożytniczego lub antybiotykoterapią – w przeciwnym razie może to skutkować zafałszowaniem wyników.
- Do badania należy dostarczyć 3 próbki kału zbierane co 24-48h.
- Próbki przed dostarczeniem do badania należy przechowywać w lodówce (w temp. 2-8ºC) – niska temperatura ma na celu zahamowanie wzrostu grzybów pleśniowych oraz rozpad niektórych form pierwotniaków.
- Próbki z 3 dni można zbierać do jednego pojemnika lub osobno z każdego dnia – ważne aby pojemnik lub pojemniki podpisać: datą i godziną pobrania próbki, imieniem zwierzęcia oraz nazwiskiem właściciela
- Wielkość próbki:
- psy, koty, jeże, fretki itp.: 3 próbki kału, każda wielkości orzecha laskowego / owocu wiśni
- króliki, szynszyle, kawie domowe, chomiki itp.: 10-15 świeżych, wilgotnych „bobków”. Świeże próbki kału najlepiej pobrać, kiedy umieścimy zwierzę w pustym i czystym transporterze na 15-30 minut
– badanie wysuszonych odchodów królików i gryzoni może skutkować zafałszowaniem wyników - gady, płazy: do badania należy zebrać tylko świeżą próbkę kału, unikając zbierania kwasu moczowego, który może być wydalany w formie stałej lub płynnej – śluzowatej. Jeśli gad wydali kał do wody, należy go jak najszybciej z niej wyjąć i przełożyć do szczelnie zamykanego pojemnika. Próbka kału powinna być wielkości pestki od wiśni (bardzo małe gady i płazy) do wielkości orzecha laskowego (średniej wielkości gady i płazy) – kał, który leżał długo w wodzie oraz taki, który jest całkowicie wysuszony, nie nadaje się do badania. Próbki pobrane z terrarium o wyściółce torfowej mogą zawierać nicienie wolnożyjące.
BADANIE MOCZU: jak prawidłowo pobrać mocz do badania ogólnego?
- Mocz do badania ogólnego najlepiej pobierać rano. Należy pamiętać aby w przeddzień pobrania próbki unikać nadmiernego wysiłku fizycznego zwierzęcia – może to skutkować wzrostem stężenia białka oraz ciał ketonowych w moczu.
- Próbkę do badania należy pobrać w sposób jak najbardziej czysty, unikając zanieczyszczenia środowiskowego. Mocz zebrany z podłogi poprzez wessanie do strzykawki może być zakwalifikowany wyłącznie do badania ogólnego – przy czym w osadzie mogą być stwierdzone elementy świadczące o zanieczyszczeniu i nieodpowiednim pobraniu próbki.
- Próbkę moczu należy dostarczyć do badania w pojemniku do pobierania moczu, probówce z korkiem lub w strzykawce zabezpieczonej zatyczką (NIE igłą).
- Pojemnik z moczem podpisać: datą i godziną pobrania próbki, imieniem zwierzęcia oraz nazwiskiem właściciela
- Minimalna objętość moczu wymagana do badania ogólnego to 3 ml. Optymalna ilość moczu to 5-10 ml